Zaterdag 23 september 2000
Mijn thermodynamische Berekeningen

Ik heb mijn tafel met laptop onder de iep gezet. Deze olm staat op het veldje naast mijn villa en is net zo oud als het huis. De iepenziekte is eraan voorbij gegaan. 's Nachts strijkt er een ransuil neer op een vaste tak om daar de muizen te verteren, die hij ving in het bosje in gindse klaverbladkrul bij de autosnelweg. Een bosje ooit geplant voor de landschappelijke inpassing van de snelweg.
De wind is oost, het verkeersgeraas waait vandaag de andere kant op.
Wat een dag!
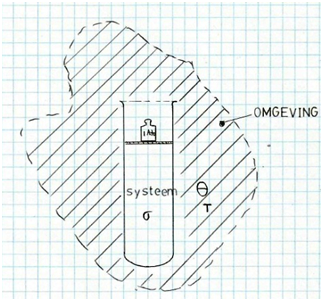
Lezer, voordat je mag doorklikken naar de eerste delftover, laat ik je eerst kennismaken met de berekeningssystematiek die ik voor het opzetten van de tovers heb toegepast. In een eerder stukje heb ik al verteld dat het er steeds om gaat het totale entropische effect te berekenen van de verandering van de toestand van een bepaald systeem, bijvoorbeeld de inhoud van een hoogoven of de groei van een boom. En dat de totale entropiestijging een optelling is van de toename van de vormingsentropie ΔSσ van het systeem σ zèlf, van de toename van de configuratie-entropie ΔScf veroorzaakt ddor verspreiding van delen van het systeem in de omgeving θ , en van de toename van de thermische entropie ΔSθ van de omgeving.
- Vorming ΔSσ
- Spreiding ΔScf
waarin:
d staat voor 'oneindig kleine toename van';
S is de entropie;
Q is de toegevoerde warmte aan het systeem σ uit omgeving θ;
T is de temperatuur van het systeem.
Substitueer (2) en (3) in (1): dU = T . dS - p . dV (4)
De verandering van het volume geeft een verandering van de gastemperatuur dT,
waarvoor geldt: dU = cv . dT (5)
waarin:
cv is de warmtecapaciteit van het gas.
Volgens de gaswet van Boyle en Gay-Lussac geldt p . V = R . T ofwel p = R . T / V (6)
waarin:
R is de gasconstante, R = 8,314462
Substitueer (5) en (6) in (4) : cv . dT = T . dS - R . T . dV / V
delen door T dS = cv . dT / T + R . dV / V
integreren S = cv . ln T + R . ln V
Als door verschuiving van de zuiger het gasvolume gaat van V1 naar V2 en T gelijk blijft door aanvulling U met warmte uit θ dan geldt:
S1 = cv . ln T + R . ln V1
en S2 = cv . ln T + R . ln V2
De entropietoename als gevolg van de spreiding van het gas van V1 naar V2 is dan:
S2 - S1 = ΔScf gas = R . (ln V2 - ln V1 ) = -R . ln (V2 / V1). (7) Hetgeen te bewijzen was.
Nu terug naar het voorbeeld. Ga V1 en V2 invullen. V1 is het volume van 1 mol CO2 bij kamertemperatuur en druk 1 atmosfeer. Dit volume is gelijk aan dat van 1 mol ideaal gas onder dezelfde omstandigheden. Uit mijn tabel met gegevens haal ik V1 mol ideaal gas = 0,022 m³. V2 is het volume van de atmosfeer. In mijn tabel schat ik die op 4,1 . 1019 m3.
Alles invullen in (7):
ΔScf verspreiding 1 mol CO2 = 8,314462 . ln (4,1 . 1019 / 0,022) = 410 J/°K.mol
Echter! Ik ging uit van een ideale situatie waarbij het gas onder de zuiger oneindig langzaam uitzet, de zuiger geen arbeid verricht en p in evenwicht is met de gasdruk in de zuiger. Van dit laminaire uitzetten is natuurlijk geen sprake in een hoogoven waar de gevormde CO2 turbulent de schoorsteen verlaat en zich spreiden gaat in een turbulente atmosfeer. In de praktijk zal ΔScf hoger uitvallen dan de berekende ideale situatie. Daar komt nog bij dat de dichtheid in de dampkring onderin veel hoger is dan bovenin. De formule geeft dus een orde van grootte van ΔScf. Maar daar ben ik meer dan tevreden mee, want de entropische waarde van een systeem is onmogelijk nauwkeurig te bepalen omdat systemen voortdurend veranderen. Zelfs de entropie van de platina standaard meter in het Archief te Parijs is niet stabiel. Het platina verspreidt langzaam door verdamping. De entropie is even fijnvoelend als een vlinder op een vleugje zomerwind.
- Opwarming ΔSθ
Er zijn toestandsveranderingen die warmte nodig hebben om te kunnen gebeuren, bijvoorbeeld het smelten van ijs, andere toestandsveranderingen gebeuren juist doordat warmte aan het reactieve systeem wordt ontnomen, bijvoorbeeld het bevriezen van water. In al deze gevallen wordt de warmte geleverd dan wel opgenomen door de omgeving θ, in mijn geval de biosfeer. De biosfeer op haar beurt heeft weer een warmterelatie met het heelal. Zolang de gemiddelde temperatuur van de biosfeer stabiel is zal er geen entropieverandering plaatsvinden, stijgt de temperatuur echter duurzaam, dan wèl. Want dan is de energie-inhoud van de dampkring blijvend toegenomen. Je snapt het al, het broeikaseffect is het voorbeeld van dit millenium. Als je de relatie kent tussen hoeveelheid geëmitteerd broeikasgas en de erdoor veroorzaakte duurzame opwarming van de dampkring, dan kun je met behulp van de bovengenoemde formule dS = dQ/T eenvoudig de ermee gemoeide entropiestijging berekenen.
Vorming,spreiding en opwarming. Het interne milieu van de stof. Dat is entropie. Je bent nu voorbereid, je mag doorklikken naar Delftover 0.
Met vreugde heb ik vele jaren
IJverig ernaar gestreefd,
Uit te vorsen, te ervaren,
Hoe natuur, al wordend, leeft.
Zie, hoe zich het enig Ene
In de veelheid openbaart.
Klein het grote, groot het kleine
Alles naar zijn eigen aard,
Steeds uiteengaan, samenkomen,
Nabij wordt ver en ver nabij,
Alles vormt zich, vormt zich om; en
Ik hier: ik verwonder mij.
J.W. von Goethe.
