 Klaar!
Klaar!
Als van de posten Gereedschappen, Men Neme en Roeren en Mengen de prijs is bepaald en de prijzen bij elkaar zijn geteld en als dan ook het Pandgeld erbij is geteld, dan is het klaar. De som van de prijzen is dan de prijs van de betreffende tover.
Klaar dus, het schema dat ik ooit op de Markt van Delft bedacht, dat staat, het is uitgelegd en begrepen. Maar nu vraag ik jou: wat heb ik nou anders gedaan dan mijn moeder toen zij de prijzen bepaalde van mijn vaders meubelproducten? Net als mijn moeder heb ik alle prijscomponenten bij elkaar geteld, het arbeidsloon, de huur van de werkplaats, de kapitaalgoederen zoals de draaibank en de grondstoffen: het Slavonisch eiken, het grenen van de redceder of het zachte lindenhout voor het snijwerk. Geheel volgens de standaard leerboeken Kostprijsberekening. Wat is dan toch het verschil?
Maar kijk, daar was het gummetje, dat beduimelde stufje waarmee moeder haar potloodprijzen behandelde net zolang tot ze tevreden was. Dat mist bij mij, mijn prijzen liggen vast, het zijn de toestandsveranderingen zèlf zou je kunnen zeggen. Menselijk gemanipuleer sloot ik uit. Op deze prijzen heb ik geen invloed, ik doe niet anders dan ze voorlezen uit het boek der natuur.
Maar nog veel belangrijker: mijn prijzen zijn inclusief het externe milieueffect. De prijs van de zogenaamde milieuverontreiniging is inbegrepen. Toen daar op die gedenkwaardige dag op de Markt van Delft het draaiorgel zweeg en het lied verklonk, toen was de toestand van de Aarde voorgoed, duurzaam en onomkeerbaar veranderd. De prijs van deze verandering is in mijn prijzensystematiek opgenomen.
Tot slot essentieel en eigenlijk had ik hiermee moeten beginnen: het eigendomsrecht van een pand aan een ander overdoen zonder daar iets voor te vragen omdat er geen toestand verandert, dat kan bij mij niet. De nieuwe eigenaar moet dan altijd nog de eigenwaarde betalen van het artikel dat hij/zij/het krijgt. Het pandgeld.
![]()
Mijn vader had een heel ander gevoel bij 'Klaar'. Daar kwam ik achter toen ik mijn vader een keer vergezelde op zijn wekelijkse zondagmorgenwandeling buiten het dorp in het vrije veld, zoals hij dat liefkozend noemde. Hij had dat nodig voor zijn inspiratie. Dit tilt mij op, zei hij.
Het wandelde heerlijk die morgen. De Zon streelde met liefde het gewas, wilgen glansden zilvergroen en een zoete geur dreef ons tegemoet uit de rietlanden langs het meer. Diepweg in het golvende riet hoempte een roerdomp en uit het dorp kwam echoloos, gedragen door een vleugje wind, het geluid van de kerkklok.
Waarom ga je daar nooit naar toe? vroeg ik.
Even was het stil, toen haalde mijn vader de schouders op, maakte een wijds gebaar om zich heen en zei: Dit is mijn kerk! Kijk nou toch eens hoe prachtig alles leeft en beweegt, hoe het zich verzamelt tot schitterende vormen, kleuren en zulke onverwachte samenstellingen. Nooit is het klaar, steeds weer anders. Die daar in de kerk denken dat het dogma voor eeuwig vaststaat en onveranderlijk is. Dat de schepping na 6 dagen klaar was en goed was. O, o. Slaven zijn het, die dromen dat ze vrijgelaten worden en daarom niet willen dat ze wakker worden gemaakt. Wie zei dat ook al weer?
Maar die Groninger tafel dan, die in de werkplaats staat, die is toch wel klaar? waagde ik. Die heeft nu toch zijn vorm gekregen? Zijn definitieve toestand?
Een driftig gebaar.
Nee nee, het is nooit af! Die tafel die tafel ...., even slikte mijn vader van machteloosheid het niet goed te kunnen zeggen, toen barstte hij los: Die tafel is van hout, ooit gemaakt door het bladgroen uit water en lucht, toen een boom, ieder jaar anders, toen in planken, toen geschaafd meubelhout, toen samengesteld tot een blad, een lade, poten, gelakt in Zweeds grijs ... maar hij zal ooit weer uit elkaar gaan, misschien wel verbranden en dan gaan de stofdeeltjes van de tafel weer op reis naar andere configuratie, andere vormen, andere pracht. Dat is het! Klaar? Nooit klaar! Als iets klaar is, dan is het slechts voorbij, gebeurd, een verandering in een oneindige reeks veranderingen.
Weet je, thuis is ma bezig met het stomen van een boffert. Straks als wij thuiskomen, dan is die klaar...ja ja klaar om door ons te worden opgegeten! 'Klaar' is slechts een onbetekenend tussenwoordje, als je ergens klaar mee bent, dan ben je meteen ook ergens klaar vóór.
Zo bleef mijn vader nog even doorgaan. Nu was hij terechtgekomen bij het probleem dat die Groninger draaipoten onder de tafel nooit allevier tegelijk twee aan twee symmetrisch waren te krijgen. Maar ik luisterde al niet meer, getroffen door wat hij eerder zei. Ik wilde nog vragen of dit dan de vooruitgang was, maar mijn vader was me voor. Iemand zou eens een keer een waarden-loos woordenboek moeten samenstellen, mopperde hij, maar dat kun je aan een menselijk wezen niet vragen.
De kerkklok was allang opgehouden.
De stilte was weer terug, de veldleeuwerikjes kon je weer horen, een tureluur jodelde en in de kerk kregen ze de zegen.
Zo gingen wij langs het toverpad van mijn vader.
BRONNEN
- welke gereedschappen worden ingezet en hoeveel uren per jaar;
- hoeveel arbeiders en hoeveel uren per arbeider per jaar;
- welke grondstoffen/(half)fabrikaten en hoeveel per jaar;
- welke produkten en hoeveel per jaar;
- hoeveel energie fossiel en duurzaam wordt jaarlijks ingezet;
- het produktierecept per produkt;
- de inhoud van de bedrijfshallen in m3 ;
- welke transportmiddelen en hoeveel produktkilometers per jaar;
Deze informatie zou te vinden moeten zijn in de jaarlijkse duurzaamheidsverslagen die bedrijven sinds 2000 meer en meer zijn gaan opstellen. Dit doen zij aan de hand een format dat - voor het eerst in 2000 - door de nonprovit-organisatie GlobalReportingInitiative GRI is uitgebracht. Deze matrix worden regelmatig bijgewerkt en heeft sinds 2016 de status van globale standaard.
- RICHTLIJN 2014/95/EU dd. 2014 inzake het registreren en rapporteren over niet-financiële informatie en informatie over diversiteit door bedrijven is weliswaar door de meeste lidstaten in wetgeving omgezet, maar de richtlijn is erg algemeen geformuleerd en geldt alleen voor bedrijven met meer dan 500 medewerkers; de hierboven bedoelde informatie wordt niet eenduidig door de richtlijn gevraagd;
- Uit concurrentieoverwegingen zijn bedrijven meestal terughoudend met het verschaffen van informatie over hoe het in de keuken van het bedrijf eraan toe gaat;
- slechts bedrijven die zich erop laten voorstaan volledig duurzaam te zijn of daarin voorop te lopen maken gedetailleerde verslagen; andere bedrijven maken gedetailleerde verslagen onder druk van aktiegroepen, omwonenden, lokale overheden;
- duurzaamheidsverslagen worden opgesteld op hetzelfde abstractieniveau als jaarverslagen, dat wil zeggen één verslag jaarlijks voor de gehele ondernemingsrechtspersoon. Voor kleine bedrijven met slechts één vestiging waar geproduceerd wordt werkt dit goed, maar voor multinationals met tientallen fabrieken verspreid over de Aarde leidt dit tot verslagen die weinig tot niets vertellen over een individuele vestiging x in land y;
- de GRI-richtlijn wordt weliswaar regelmatig bijgewerkt en aangevuld, maar schiet niettemin tekort als het gaat om puntig doorvragen naar de hierboven bedoelde gegevens;
Dat valt dus tegen, maar hoe dan wel? Gelukkig is daar het Gemeenschappelijk Centrum voor Onderzoek van de Europeese Commissie. Onderdeel van dit directoraat-generaal is het IPPC Bureau, de dienst voor Integrated Pollution Prevention and Control. Dit bureau stelt gedetailleerde kwantitatieve inventarisaties op van gangbare grote en kleine industriële processen in Europa met daarnaast beschrijvingen van de beste beschikbare technieken BAT (best available techniques), inclusief thermodynamische kengetallen. Echt goed! Al deze informatie wordt gepubliceerd onder de noemer BREF-documents (BAT Reference Documents).


Voorbeeldpagina's uit een BREF-document over de productie van ammonia.
Ook is er nog The Essential Chemical Industry Online, een web-bibliotheek met veel informatie over industriële processen, oorspronkelijk uitgegeven door de Universiteit van York in Engeland. Deze webzij informeert over de gangbare recepturen bij tal van chemische produktieprocessen.
Verder zijn er nog tal van webzijden die technische informatie geven over heel bepaalde technieken en processen. Deze bronnen worden, waar gebruikt, steeds vermeld onderaan de tovers.
~~~~~~~~~~
Het gaat steeds over Physische Chemie
De warmteleer is een typisch fenomeen uit het tijdperk van de stoommachines en kreeg in dat tijdperk met als belangrijke pioniers Boltzmann en Gibbs haar grondvorm. Sindsdien is de thermodynamica uitgegroeid tot de conceptuele basis voor met name wis- en natuurkunde en scheikunde. De scheikunde verdiepte zich met de discipline physische chemie, die bij de berekening van al de tovers van deze webzijde een belangrijke rol speelt. Het is entropische analyse. Ook Nederlandse wetenschappers hebben aan de ontwikkeling van de physische chemie bijgedragen. Namen: Van der Waals, Van 't Hoff en Lorentz. Van 't Hoff richtte in 1887 samen met Ostwald het Zeitschrift für Physikalische Chemie op. Ik kan het niet laten enige Nederlanders te noemen die over de warmteleer schreven en daarbij opvielen. Hier komen ze:

 In 1908 werd uit de leerstoel van Van der Waals de leerstoel Thermodynamica afgesplitst en Philipp Kohnstamm werd de eerste hoogleraar die daarop plaats mocht nemen. In later jaren werd hij een vernieuwer op het terrein van de pedagogiek. Reden waarom de Maatschappij tot Nut van 't Algemeen hem vroeg om voor de Wereldbibliotheek - de Maatschappij voor goedkope en goede lectuur - een voor de arbeider begrijpelijke verhandeling te schrijven over dit betrekkelijk nieuwe en intrigerende kennisveld.
In 1908 werd uit de leerstoel van Van der Waals de leerstoel Thermodynamica afgesplitst en Philipp Kohnstamm werd de eerste hoogleraar die daarop plaats mocht nemen. In later jaren werd hij een vernieuwer op het terrein van de pedagogiek. Reden waarom de Maatschappij tot Nut van 't Algemeen hem vroeg om voor de Wereldbibliotheek - de Maatschappij voor goedkope en goede lectuur - een voor de arbeider begrijpelijke verhandeling te schrijven over dit betrekkelijk nieuwe en intrigerende kennisveld.
"Thermodynamica" door Dr. H.A. Lorentz, lessen over Theoretische Natuurkunde, E.J. Brill 1929;

"Entropie en Waarschijnlijkheid" door Dr. H.A. Lorentz, lessen over Theoretische Natuurkunde, E.J. Brill 1923.
Brill 1923.
De lessen zelf gaf Hendrik Lorentz al in 1910-1911. In die tijd was de statistische verklaring van het begrip entropie door Ludwig Boltzmann nog tamelijk nieuw. In zijn verhandeling over entropie spreekt Lorentz bij dit onderdeel steeds een beetje voorzichtig van de 'methode Boltzmann'. Overigens:hij kende Boltzmann persoonlijk, correspondeerde met hem en steunde diens 'methode'.
"De beide hoofdwetten der Thermodynamica en hare voornaamste toepassingen" door Dr. G.L de Haas-Lorentz, Martinus Nijhoff 1938; 

Geertruide Lorentz - dochter van de beroemde vader - schreef dit werk volgens haar persoonlijke opvattingen over didactiek die afweken van wat toen in de meeste leerboeken gangbaar was. Dit deed zij in nauw overleg met Tatiana Afanassjewa, de vrouw van Paul Ehrenfest die Hendrik Lorentz was opgevolgd. Interessant is haar behandeling van de niet-waarneembare grootheid X die dan naderhand de entropie blijkt te zijn.
"Thermodynamica en statistiek in de chemie" door Dr. J. Zernike, Kluwer Deventer 1942; 




De inhoud van deze leerboeken is niet altijd gezellig omdat het eigenlijk een saai onderwerp is, bijna net zo saai als klassieke ekonomie.
 Maar deze schijn bedriegt, het wezen is vol kleur en smaak. De schijn is slechts de werkelijkheid, het wezen is de ingewikkeldheid.
Maar deze schijn bedriegt, het wezen is vol kleur en smaak. De schijn is slechts de werkelijkheid, het wezen is de ingewikkeldheid.
Zaterdag 23 september 2000
Mijn thermodynamische Berekeningen

Ik heb mijn tafel met laptop onder de iep gezet. Deze olm staat op het veldje naast mijn villa en is net zo oud als het huis. De iepenziekte is eraan voorbij gegaan. 's Nachts strijkt er een ransuil neer op een vaste tak om daar de muizen te verteren, die hij ving in het bosje in gindse klaverbladkrul bij de autosnelweg. Een bosje ooit geplant voor de landschappelijke inpassing van de snelweg.
De wind is oost, het verkeersgeraas waait vandaag de andere kant op.
Wat een dag!
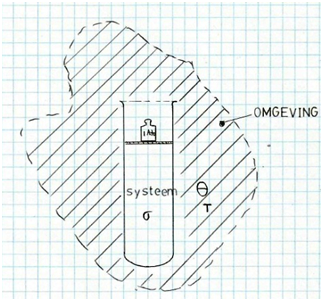
Lezer, voordat je mag doorklikken naar de eerste delftover, laat ik je eerst kennismaken met de berekeningssystematiek die ik voor het opzetten van de tovers heb toegepast. In een eerder stukje heb ik al verteld dat het er steeds om gaat het totale entropische effect te berekenen van de verandering van de toestand van een bepaald systeem, bijvoorbeeld de inhoud van een hoogoven of de groei van een boom. En dat de totale entropiestijging een optelling is van de toename van de vormingsentropie ΔSσ van het systeem σ zèlf, van de toename van de configuratie-entropie ΔScf veroorzaakt ddor verspreiding van delen van het systeem in de omgeving θ , en van de toename van de thermische entropie ΔSθ van de omgeving.
- Vorming ΔSσ
- Spreiding ΔScf
waarin:
d staat voor 'oneindig kleine toename van';
S is de entropie;
Q is de toegevoerde warmte aan het systeem σ uit omgeving θ;
T is de temperatuur van het systeem.
Substitueer (2) en (3) in (1): dU = T . dS - p . dV (4)
De verandering van het volume geeft een verandering van de gastemperatuur dT,
waarvoor geldt: dU = cv . dT (5)
waarin:
cv is de warmtecapaciteit van het gas.
Volgens de gaswet van Boyle en Gay-Lussac geldt p . V = R . T ofwel p = R . T / V (6)
waarin:
R is de gasconstante, R = 8,314462
Substitueer (5) en (6) in (4) : cv . dT = T . dS - R . T . dV / V
delen door T dS = cv . dT / T + R . dV / V
integreren S = cv . ln T + R . ln V
Als door verschuiving van de zuiger het gasvolume gaat van V1 naar V2 en T gelijk blijft door aanvulling U met warmte uit θ dan geldt:
S1 = cv . ln T + R . ln V1
en S2 = cv . ln T + R . ln V2
De entropietoename als gevolg van de spreiding van het gas van V1 naar V2 is dan:
S2 - S1 = ΔScf gas = R . (ln V2 - ln V1 ) = -R . ln (V2 / V1). (7) Hetgeen te bewijzen was.
Nu terug naar het voorbeeld. Ga V1 en V2 invullen. V1 is het volume van 1 mol CO2 bij kamertemperatuur en druk 1 atmosfeer. Dit volume is gelijk aan dat van 1 mol ideaal gas onder dezelfde omstandigheden. Uit mijn tabel met gegevens haal ik V1 mol ideaal gas = 0,022 m³. V2 is het volume van de atmosfeer. In mijn tabel schat ik die op 4,1 . 1019 m3.
Alles invullen in (7):
ΔScf verspreiding 1 mol CO2 = 8,314462 . ln (4,1 . 1019 / 0,022) = 410 J/°K.mol
Echter! Ik ging uit van een ideale situatie waarbij het gas onder de zuiger oneindig langzaam uitzet, de zuiger geen arbeid verricht en p in evenwicht is met de gasdruk in de zuiger. Van dit laminaire uitzetten is natuurlijk geen sprake in een hoogoven waar de gevormde CO2 turbulent de schoorsteen verlaat en zich spreiden gaat in een turbulente atmosfeer. In de praktijk zal ΔScf hoger uitvallen dan de berekende ideale situatie. Daar komt nog bij dat de dichtheid in de dampkring onderin veel hoger is dan bovenin. De formule geeft dus een orde van grootte van ΔScf. Maar daar ben ik meer dan tevreden mee, want de entropische waarde van een systeem is onmogelijk nauwkeurig te bepalen omdat systemen voortdurend veranderen. Zelfs de entropie van de platina standaard meter in het Archief te Parijs is niet stabiel. Het platina verspreidt langzaam door verdamping. De entropie is even fijnvoelend als een vlinder op een vleugje zomerwind.
- Opwarming ΔSθ
Er zijn toestandsveranderingen die warmte nodig hebben om te kunnen gebeuren, bijvoorbeeld het smelten van ijs, andere toestandsveranderingen gebeuren juist doordat warmte aan het reactieve systeem wordt ontnomen, bijvoorbeeld het bevriezen van water. In al deze gevallen wordt de warmte geleverd dan wel opgenomen door de omgeving θ, in mijn geval de biosfeer. De biosfeer op haar beurt heeft weer een warmterelatie met het heelal. Zolang de gemiddelde temperatuur van de biosfeer stabiel is zal er geen entropieverandering plaatsvinden, stijgt de temperatuur echter duurzaam, dan wèl. Want dan is de energie-inhoud van de dampkring blijvend toegenomen. Je snapt het al, het broeikaseffect is het voorbeeld van dit millenium. Als je de relatie kent tussen hoeveelheid geëmitteerd broeikasgas en de erdoor veroorzaakte duurzame opwarming van de dampkring, dan kun je met behulp van de bovengenoemde formule dS = dQ/T eenvoudig de ermee gemoeide entropiestijging berekenen.
Vorming,spreiding en opwarming. Het interne milieu van de stof. Dat is entropie. Je bent nu voorbereid, je mag doorklikken naar Delftover 0.
Met vreugde heb ik vele jaren
IJverig ernaar gestreefd,
Uit te vorsen, te ervaren,
Hoe natuur, al wordend, leeft.
Zie, hoe zich het enig Ene
In de veelheid openbaart.
Klein het grote, groot het kleine
Alles naar zijn eigen aard,
Steeds uiteengaan, samenkomen,
Nabij wordt ver en ver nabij,
Alles vormt zich, vormt zich om; en
Ik hier: ik verwonder mij.
J.W. von Goethe.
GEBRUIKTE SYMBOLEN, KENGETALLEN EN WAARDEN
Bij mijn berekeningen gebruik ik veelvuldig de volgende symbolen, kengetallen en door mij geschatte intensieve en extensieve toestandsgrootheden.
De eenheden zijn gebaseerd op het meterkilogramseconde-stelsel.
Een intensieve toestandsgrootheid is onafhankelijk van de hoeveelheid stof in een systeem. Een extensieve grootheid is evenredig met de hoeveelheid stof in dat systeem.
Voorbeelden van intensieve toestandsgrootheden: temperatuur, druk.
Voorbeelden van extensieve toestandsgrootheden: massa, volume, inwendige energie, entropie.
| Symbolen | |
| Versnelling | a |
| Druk | B |
| Configuratie | cf |
| Capaciteit, doorzetvermogen | C |
| Warmtecapaciteit | c |
| Debiet, doorzet per tijdseenheid | D |
| Omgeving | θ |
| Toename | Δ |
| Energieverbruik per tijdseenheid | E |
| Kracht | F |
| Uitbestedingsfactor | fu |
| Kostgangersfactor | fk |
| Versnelling door de zwaartekracht | g |
| Vormingswarmte | Hf |
| Intensiteit | i |
| Joule, Newtonmeter | J |
| Kilogrammassa | kg |
| Graad Kelvin | °K |
| Lading | L |
| Meter, massa | m |
| Rendement | μ |
| Molmassa | M |
| Getal van Avogadro | NA |
| Newton | N |
| Aantal molen | n |
| Oppervlak | O |
| Vermogen, gasdruk, spanning | P |
| Aantal werknemers | pw |
| Aantal mensen | pm |
| Warmte-energie | Q |
| Inzetquotient | qi |
| Gasconstante | R |
| Soortelijke massa, dichtheid | ρ |
| Seconde, afgelegde weg | s |
| Entropie | S |
| Systeem | σ |
| Temperatuur | T |
| Inzettijd | Ti |
| Diensttijd | Td |
| Tijd | t |
| Tover, munteenheid | |
| Inwendige energie | U |
| Volume | V |
| Snelheid | v |
| Arbeid | W |
| Molaire massa’s M in kg/mol | |
| Droge lucht | 0,029 |
| O2 | 0,032 |
| CO2 | 0,044 |
| C | 0,012 |
| Natuurconstanten | |
| Constante van Boltzmann kB | 1,38.1023 Tv/mol |
| Getal van Avogadro NA | 6.1023 |
| Gasconstante R = NA.kB | 8,3 Tv/mol |
| Volume 1 mol ideaal gas Vmolidgas | 0,022 m³ op zeeniveau |
| Valversnelling g in huisje Helder | 9,8 m/sec². |
| Geschatte grootheden | |
| De luchtdruk op zeeniveau P0 | N/m² |
| Gemiddelde temperatuur Tdampkring | 273 °K. |
| Hoogte atmosfeer H | 35000 m |
| Straal aardbol Raarde | 6,4 . m |
| Oppervlak aardbol Oaarde | 128 . 1012 m². |
| Inhoud dampkring Vdampkring | 3,5 . |
| Warmtecapaciteit droge lucht clucht | 37 J/mol lucht.°K |
| Inhoud oceaan Voceaan | 1,3 . |
| Warmtecapaciteit water cwater | 4,2.106 J/m3 |
Verder hanteerde ik tabellen van thermodynamische eigenschappen van standaard-toestanden, zie de volgende bronnen:
National Institue of Standards and Technology NIST
https://webbook.nist.gov/chemistry/form-ser/
U.S. National Library of Medicine
https://pubchem.ncbi.nlm.nih.gov/compound/19601290
Dean, John A. Lange’s Handbook of Chemistry, 11th ed.; McGraw-Hill: New York, New York, 1979; pp 9:4-9:128.Lide, David R. CRC Handbook, 84th ed.; CRC Press: Boca Raton, Florida, 2003; pp 5:5-5:60, 5:85-5:86.
http://chemistry-reference.com/standard%20thermodynamic%20values.pdf
Uppsala Universitet
http://www.update.uu.se/~jolkkonen/pdf/CRC_TD.pdf
Thermodynamic Properties of Minerals and Related Substances at 298.15 K and ...
Door Richard A. Robie, Bruce S. Hemingway
Voor technische informatie over industriéle basisprocessen was een belangrijke, neutrale bron:
The European IPPC Bureau (Integrated Pollution Prevention and Control)
http://eippcb.jrc.ec.europa.eu/reference/
DE TOEDELINGSFACTOR
Het komt nogal eens voor dat met een enkele fabriek twee of meer verschillende produkten worden aangemaakt uit dezelfde grondstof. Hoe bepaal je dan de prijs per produkt? Welk gedeelte van de totale toestandsverandering, uitgedrukt in tovers, ken je toe per produkt?
Om dat te kunnen heb je voor ieder produkt een toedelingsfactor nodig. Deze factor is gedefiniëerd als het quotient van de eigenwaarde van het betreffende produkt en de som van de eigenwaarden van alle produkten.
Hoe bepaal je de toedelingsfactor in de praktijk? Dat laat ik je zien aan de hand van een eenvoudig geïntegreerd produktieproces, te weten de simultane produktie van waterstof en zuurstof uit water door middel van elektrolyse. Dat heb je op school vast wel gehad.

Eerst de prijs van een ton waterstof. Daarvoor stellen we het Overzicht op:




