Samstag, 23. September 2000
Meine thermodynamischen Berechnungen

Ich legte meinen Tisch mit Laptop unter die Ulme. Dieser Olm ist auf dem Feld neben meiner Villa und ist so alt wie das Haus. Die Ulmenkrankheit ist vorüber. Nachts setzt sich eine Lösegeldeule auf einen festen Ast, um die Mäuse zu verdauen, die er im Busch in der Nähe der Autobahn gefangen hat. Ein Hain, der einst für die landschaftliche Integration der Autobahn gepflanzt wurde.
Der Wind ist östlich, der Verkehrslärm weht heute in die andere Richtung.
Was für ein Tag!
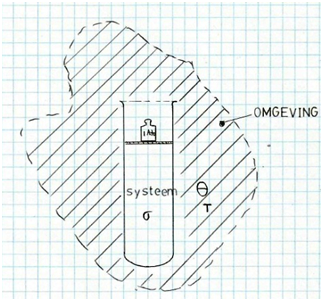
Leser, bevor Sie sich zum ersten Delftover durchklicken können, werde ich Ihnen zuerst das Berechnungssystem vorstellen, mit dem ich die Magier eingerichtet habe. In einem früheren Stück Ich habe bereits gesagt, dass es immer darum geht, den gesamten entropischen Effekt der Zustandsänderung eines bestimmten Systems zu berechnen, zum Beispiel den Inhalt eines Hochofens oder das Wachstum eines Baumes. Und dass der Gesamtentropieanstieg eine Addition der Zunahme der Formationsentropie ist ΔSσ des Systems σ selbst, aus der Zunahme der Konfiguration Entropie ΔSvgl verursacht Ddor-Ausbreitung von Teilen des Systems in der Umwelt θ , und der Anstieg der thermischen Entropie ΔSθ der Umwelt.
- Bildung ΔSσ
- Verteilung ΔSvgl
in dem:
d steht für "infinitely small increase of".
S ist die Entropie.
Q ist die dem System zugeführte Wärme σ aus der Umgebung θ;
T ist die Temperatur des Systems.
Substitute (2) und (3) in (1): dU = T. dS - p. dV (4)
Die Änderung des Volumens ergibt eine Änderung der Gastemperatur dT,
zu dem: dU = cv . dT (5)
in dem:
cv ist die Wärmekapazität des Gases.
Laut Boyle und Gay-Lussac Gas Gesetz, p. V = R. T oder p = R. T/V (6)
in dem:
R ist die Gaskonstante, R = 8.314462
Ersetzung (5) und (6) in (4): cv . dT = T . dS - R . T. dV/V
dividiert durch T dS = cv . dT / T + R . dV / V
integrieren S = cv . ln T + R . ln V
Wenn durch Verschieben des Kolbens das Gasvolumen von V geht1 bis V2 und T bleibt gleich, indem U mit Heat Out ergänzt wird θ dann:
S1 = cv . ln T + R . ln V1
und S2 = cv . ln T + R . ln V2
Die Zunahme der Entropie durch die Dispersion von V-Gas1 bis V2 ist:
S2 - S1 = ΔSvgl Gas = R. (ln V2 - ln V1 ) = -R . ln (V2 / V1). (7) Das, was bewiesen werden sollte.
Nun zurück zum Beispiel. Go V1 und V2 Füllen Sie aus. V1 ist das Volumen von 1 mol CO2 bei Raumtemperatur und Druck 1 Atmosphäre. Dieses Volumen entspricht dem von 1 Mol idealem Gas unter den gleichen Bedingungen. Raus aus meinem Tisch Mit Daten bekomme ich V1 Mol ideales Gas = 0,022 m3 V2 ist es Volumen der Atmosphäre. In meiner Tabelle schätze ich den Wert auf 4,1. 1019 m3.
Komplett in (7):
ΔSvgl Dispersion 1 mol CO2 = 8.314462 . ln (4,1 . 1019 / 0,022) = 410 J/°K.mol
Aber wie auch immer! Ich nahm eine ideale Situation an, in der sich das Gas unter dem Kolben unendlich langsam ausdehnt, der Kolben keine Arbeit leistet und p im Gleichgewicht mit dem Gasdruck im Kolben ist. Natürlich gibt es keine Frage dieser laminaren Expansion in einem Hochofen, wo die gebildete CO2 Turbulent den Schornstein verlassen und sich ausbreiten geht in eine turbulente Atmosphäre. In der Praxis wird ΔScf höher sein als die berechnete ideale Situation. Darüber hinaus ist die Dichte in der Atmosphäre am Boden viel höher als an der Spitze. Die Formel gibt eine Größenordnung von ΔScf an. Aber damit bin ich mehr als zufrieden, weil der entropische Wert eines Systems nicht genau bestimmt werden kann, weil sich die Systeme ständig ändern. Selbst die Entropie des Platin-Standardmeters im Archiv in Paris ist nicht stabil. Das Platin breitet sich langsam durch Verdunstung aus. Die Entropie ist so zart wie ein Schmetterling bei einem Hauch von Sommerwind.
- Erwärmung ΔSθ
Es gibt Zustandsänderungen, die Wärme benötigen, zum Beispiel das Schmelzen von Eis, andere Zustandsänderungen geschehen genau deshalb, weil Wärme aus dem reaktiven System entnommen wird, zum Beispiel das Einfrieren von Wasser. In all diesen Fällen wird die Wärme von der Umwelt zugeführt oder absorbiert. θIn meinem Fall die Biosphäre. Die Biosphäre wiederum hat eine warme Beziehung zum Universum. Solange die Durchschnittstemperatur der Biosphäre stabil ist, wird es keine Entropieänderung geben, aber die Temperatur wird nachhaltig steigen. Denn dann hat der Energiegehalt der Atmosphäre dauerhaft zugenommen. Wie Sie sehen können, ist der Treibhauseffekt das Beispiel dieses Jahrtausends. Wenn Sie den Zusammenhang zwischen der Menge des emittierten Treibhausgases und der dadurch verursachten nachhaltigen Erwärmung der Atmosphäre kennen, können Sie den damit verbundenen Entropieanstieg leicht mit der obigen Formel dS = dQ/T berechnen.
Bildung, Dispersion und Erwärmung. Das innere Umfeld der Substanz. Das ist Entropie. Sie sind nun vorbereitet, Sie können sich durchklicken, um Delftover 0.
Mit Freude habe ich viele Jahre
Idioten bemühen sich, dies zu tun,
Erforschen, Erleben,
Wie die Natur, das Werden, das Leben.
Sehen Sie, wie der eine und einzige
Enthüllt in der Menge.
Klein das Große, groß das Kleine
Alles nach seiner eigenen Natur,
Immer aufbrechen, zusammenkommen,
Es ist nah und fern,
Alles formt, transformiert; und
Ich hier:Ich bin überrascht.
J.W. von Goethe.


